骨桥蛋白诱导死亡癌细胞中的线粒体生物发生
2023年 12 月 1 日, Oncotarget 第 14 卷发表了一篇新的研究论文,题为“骨桥蛋白诱导死亡癌细胞中的线粒体生物发生”。
转移细胞表现出独特的新陈代谢,这与原发肿瘤中出现的瓦伯格效应非常不同。在短时间内,氧化磷酸化和 ATP 生成很突出。在较长的时间范围内,线粒体生物发生成为一个显着特征并有助于转移成功。目前尚不清楚这两种现象是否存在关联或如何关联。
在这项新研究中,辛辛那提大学James L. Winkle 药学院的研究人员Gulimirerouzi Fnu和Georg F. Weber假设,骨桥蛋白剪接变体协同增加死亡粘附细胞中的 ATP 水平,也通过相同的信号传导增加线粒体质量机制。
“在这里,我们报告自分泌骨桥蛋白确实刺激线粒体大小的增加,剪接变体-c比全长形式-a更有效。”
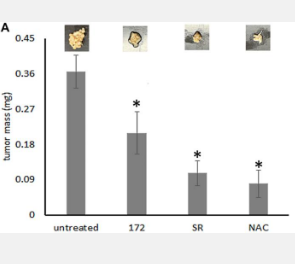
骨桥蛋白-c 通过其受体 CD44v 以及氯依赖性胱氨酸-谷氨酸转运蛋白 SLC7A11 的上调和共连接来实现这一目标。该信号传导通过激活已知的线粒体生物发生诱导剂 PGC-1(充当转录共激活剂)来进行。过氧化物是该级联中的重要中间体,但令人惊讶的是,其作用于 PGC-1 的上游,并且可能是 SLC7A11 招募和激活的结果。在体内,抑制生物发生诱导机制会导致播散性肿瘤质量减少。
“这项研究证实了癌症转移中短期氧化代谢和长期线粒体生物发生之间的功能联系——两者都是由骨桥蛋白-c 诱导的。这些结果暗示了治疗癌症转移的可能机制和目标。”
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
