阿尔茨海默病早期发现的新机制
阿尔茨海默病 (AD) 仍然是最具挑战性和最普遍的神经退行性疾病之一,影响着全世界数百万人。在《Developmental Cell》杂志上发表的一项新研究中, Wim Annaert (VIB-KU Leuven) 实验室的研究人员发现了一种可能与 AD 早期阶段相关的新机制。他们证明,淀粉样前体蛋白(APP)的一个片段(称为 APP-CTF)会破坏对钙储存和废物处理至关重要的细胞区室之间的通讯,这可能是神经元细胞死亡之前的早期事件。这些发现对开发新的 AD 治疗方法具有潜在意义,表明需要考虑防止 APP-CTF 积累,以开发更有效的治疗方法。
阿尔茨海默病的特征是认知功能进行性丧失、记忆障碍和行为改变。阿尔茨海默病患者大脑中的一个明显特征是淀粉样斑块的形成,即 β-淀粉样蛋白 (Aβ) 肽团块,它们是淀粉样蛋白前体蛋白 (APP) 的降解产物。这些 Aβ 片段在疾病早期就在神经元中积累,甚至在观察到认知能力下降之前。
然而,新的研究表明,在斑块形成之前,AD 大脑中甚至可能发生早期事件,并且 APP 蛋白在这些早期阶段发挥作用。直到现在,这背后的机制仍然是个谜。
在最新的研究中,VIB-KU 鲁汶脑与疾病研究中心的 Wim Annaert 实验室发现了一种机制,可以解释 APP 如何促进 AD 的早期阶段。这一发现可能会为 AD 研究和治疗方法带来新的方向。
破坏细胞通讯
APP 存在于脑细胞的细胞膜中。大脑不断产生新的 APP 分子,同时分解和去除旧的分子。这一过程涉及酶剪刀,γ-分泌酶是 AD 中产生众所周知且经过充分研究的 Aβ 肽的最后一个酶。
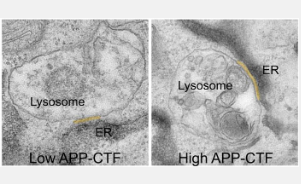
长期以来,人们认为阻断 γ-分泌酶是防止有毒 Aβ 片段产生的合理步骤。然而,这会导致其前体、APP-C 末端片段或 APP-CTF 的积累。现在,研究人员发现这些碎片对神经元也有毒。它们似乎在内质网(ER)和溶酶体(对于脂质合成和钙储存至关重要的隔室)和溶酶体(所谓的神经元“废物箱”)之间积累,溶酶体对于降解细胞的废物至关重要。
该研究的第一作者 Marine Bretou 博士解释说: “通过这样做,APP-CTF 破坏了溶酶体内钙的微妙平衡。”这种破坏引发了一系列事件。内质网无法再有效地向溶酶体补充钙,导致胆固醇积聚并降低其分解细胞废物的能力。这导致整个内溶酶体系统崩溃,而内溶酶体系统是维持健康神经元的关键途径。”
这项新研究进一步支持抑制 γ-分泌酶产生的 APP-CTF 实际上可能是内溶酶体功能障碍的罪魁祸首,正如在 AD 早期阶段所观察到的那样。
了解 AD 发病机制早期阶段的范式转变
这项研究极大地增进了我们对 AD 早期潜在疾病原因的理解。这项研究的一个显着结果是,这些早期阶段可能是由同一 APP 分子的另一个片段而不是 Aβ 引起的。这对于当前旨在清除AD大脑中淀粉样蛋白斑块的治疗方法具有重要意义,因为它们往往忽视其他碎片的毒性作用。其他尝试集中在 tau 蛋白或神经炎症上,这是针对后期事件的 AD 进展的其他标志。然而,早期干预可能是阻止甚至预防 AD 的关键。
该研究的主要作者 Wim Annaert 教授解释说:“使用 γ 分泌酶抑制剂的临床试验失败可能是因为我们只关注一个罪魁祸首,而且在疾病的晚期阶段。” “我们的研究结果表明,γ-分泌酶调节剂可以帮助促进有毒 APP-CTF 的清除,而不完全阻断该酶,可能是 AD 早期干预的更相关目标。关键可能是在 APP-CTF 清除和牙菌斑预防之间找到适当的平衡。”
展望未来,科学家们正在与同事共同努力,根据这些新见解开发这些调节剂,并将继续探索 AD 早期阶段的细胞稳态。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
