预测免疫治疗反应并指导TMB相关免疫浸润调节剂的联合治疗
肿瘤突变负荷(TMB)被认为是免疫治疗疗效的重要预测生物标志物。然而,在 TMB 与 CD8 + T 细胞丰度不呈正相关的癌症类型中,TMB 无法预测免疫治疗的疗效。这表明具有高免疫原性的肿瘤并不总是导致免疫炎症微环境表型。 TMB和免疫浸润之间的屏障作为癌症-免疫循环的初始阶段和效应阶段,需要进一步探索相同水平的TMB引起免疫浸润差异的机制。迫切需要发现和提出免疫治疗耐药的新靶点以及基于此的联合增强方法。
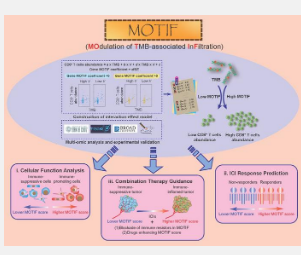
研究人员利用来自 30 种癌症类型的 9,311 个肿瘤样本的转录组测序数据,开发了 TMB 相关免疫浸润调节器 (MOTIF)。然后研究人员确信 MOTIF 阐明了癌症免疫循环的积极和消极调节因素。它还阐明了免疫细胞趋化、浸润和排斥的调节因素。肿瘤细胞 MOTIF 评分阐明了它们的功能异质性。基质细胞和免疫细胞的 MOTIF 评分与其微环境功能之间的密切关系凸显。 MOTIF 阐明了微环境中各种细胞成分与 CD8 + T 细胞之间相互作用的异质性。同时,MOTIF阐明了肿瘤细胞功能异质性与微环境中各种细胞成分之间的密切关系。微环境中各类细胞的高MOTIF评分与患者对免疫治疗的反应显着正相关。
与TMB相比,MOTIF更准确地反映患者体内CD8+T细胞浸润水平。无论突变类型和拷贝数变异如何,MOTIF 都能预测免疫浸润。 MOTIF 预测促炎性免疫细胞的丰度和癌症免疫周期的各个阶段。 MOTIF 评分高的患者免疫治疗反应率较高。 MOTIF 与 TIDE 和 TIGS 的组合提高了免疫治疗疗效的预测效率。
基于MOTIF筛选出EMC3作为肿瘤细胞中高表达的免疫浸润负调控因子。敲除肿瘤细胞 EMC3 已被证实可增强皮下肿瘤模型的免疫治疗。此外,敲除肿瘤细胞 EMC3 可通过增加微环境 CD8 + T 细胞浸润来增强免疫治疗。 RGES算法还用于筛选紫杉醇/多西他赛以提高MOTIF分数。紫杉醇/多西紫杉醇联合免疫治疗可增强疗效。紫杉醇/多西他赛通过增加 MOTIF 评分并促进微环境 CD8 + T 细胞浸润和功能来增强免疫治疗。
目前,MOTIF是第一个全面覆盖整个肿瘤免疫周期过程的预测性生物标志物。它还首次揭示了同等水平的 TMB 诱导 CD8+ T 细胞浸润能力差异背后的原因。它有助于创新免疫治疗的预测指标和敏化方法,提出将免疫抑制微环境转向免疫炎症表型的方法和手段,为免疫治疗的临床应用提供新的指导、方法和见解。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
