肠源性外泌体作为肝脂质代谢的新型介质
非酒精性脂肪肝病 (NAFLD) 的特点是肝脏脂质过度积累,患病率很高,可进展为肝硬化和肝癌。为了加强NAFLD的预防和治疗工作,深入探讨NAFLD的调控机制势在必行。鉴于肠道与肝脏之间的密切联系,肠道产生或吸收许多调节肝脏代谢的物质。据报道,源自肠道组织的外泌体通过其货物影响受体细胞的生物过程,这表明其在调节肝脂质稳态方面具有潜在作用。
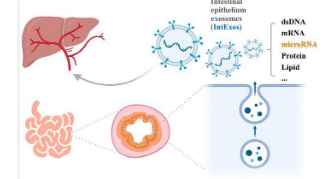
北京大学研究人员近期在《生命代谢 》杂志上发表题为“肠上皮来源的外泌体调节肝脂代谢”的研究,证实源自肠上皮细胞的外泌体(intExos)作为调节肝脂代谢的新型介质,并阐明了这一机制。通过 microRNA 的视角了解部分机制(图 1)。
结果
为了验证“肠上皮来源的外泌体调节肝脏脂质代谢”的科学假设,利用荧光追踪技术证实了肝细胞对intExos的摄取和富集。维兰-Cre ; Lgr4 flox/flox (VL) 小鼠由于肠上皮细胞的基因编辑而对高脂饮食 (HFD) 诱导的脂肪肝具有抵抗力,被选为研究模型。收集来自 VL 和对照小鼠的 IntExos,并通过尾静脉注射给予肝原代细胞以及 HFD 喂养的小鼠。实验结果一致表明,用 VL 外泌体处理的肝细胞中脂质沉积减少。对 VL 组和对照小鼠的肠上皮外泌体进行 microRNA 测序显示,VL 组中 miR-21a-5p 显着增加,而 miR-145a-5p 水平显着降低。在肝脏原代细胞和 HFD 喂养的小鼠肝脏中过度表达或沉默这些 microRNA 证实,miR-21a-5p 可减轻 NAFLD,而 miR-145a-5p 会加剧肝脂质变性。使用预测数据库鉴定了 miR-21a-5p 和 miR-145a-5p 介导其对脂质代谢影响的潜在靶基因,并通过双荧光素酶报告基因测定进行验证。进一步的细胞实验表明,miR-21a-5p下调肝脏巨噬细胞中的CC基序趋化因子配体1( Ccl1),诱导抗炎表型并间接减少肝细胞中的脂质沉积;miR-145a-5p 抑制 BTG 抗增殖因子 1 ( Btg1 ),导致硬脂酰辅酶 A 去饱和酶 1 ( Scd1 )等下游分子增加以及随后的脂质积累(图 2)。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
